Красноярские ученые предложили использовать для изучения и регистрации токсичности простейшую биологическую систему — целентерамид-содержащие флуоресцентные белки.

Белки некоторых морских светящихся кишечнополостных могут служить индикатором токсичности среды
Фото: DIOMEDIA
Механизмы токсических эффектов представляют собой наиболее злободневный предмет фундаментальных исследований в области токсикологии. Известно, что токсичность — биологическое понятие; оно означает подавление физиологических функций организмов под действием химических агентов или радиации. Количественно токсичность определяется с помощью биотестовых систем; в качестве таких систем возможно использование организмов различной сложности — начиная от высших и заканчивая клеточными.
Обычно наибольший интерес вызывает токсическое воздействие на сложные биосистемы, такие как человеческий организм или высшие животные. Вместе с тем, изучение токсических эффектов с использованием более простых "кирпичиков" этих организмов — клеток или ферментативных реакций — позволяет понять механизмы токсических эффектов, соответственно, на клеточном или биохимическом уровне. Так, например, понимание биохимических механизмов токсичности дает возможность создавать лекарственные препараты направленного действия.
Недавно красноярские ученые предложили использовать для изучения токсичности еще более простую биологическую систему — особые флуоресцентные белки. Они полагают, что использование этих белков способно перевести понимание токсических эффектов на базовый уровень — уровень элементарных физико-химических процессов.
Сотрудники Института биофизики КНЦ СО РАН и Сибирского федерального университета (Красноярск) давно изучают токсические эффекты с помощью биотестовых систем, способных испускать свет — люминесцировать. Люминесценция — физическое явление, ее интенсивность регистрируется с помощью простых физических приборов. Именно поэтому люминесцентное биотестирование токсичности широко распространено в мировой практике. Наиболее часто используются люминесцентные морские бактерии — одноклеточные организмы, которые встречаются в море как в свободном виде, так и в светящихся органах рыб. В последние десятилетия набирают популярность ферментативные люминесцентные биотесты, то есть ферментативные реакции светящихся бактерий. Недавно сибирскими учеными предложено использование целентерамид-содержащих флуоресцентных белков, которые являются продуктами биолюминесцентных реакций некоторых морских светящихся кишечнополостных — медуз, полипов. В отличие от "зеленых" флуоресцентных белков, которые в настоящее время широко используются в качестве флуоресцентных меток в медицинских и биологических исследованиях, целентерамид-содержащие белки не получили широкого признания, и их потенциал явно недооценен. Спектры флуоресценции этих белков могут варьироваться за счет формирования различных флуоресцентных форм. Соотношение между этими формами определяется эффективностью фотохимического переноса протона, а она, в свою очередь, зависит от воздействия токсичных веществ на белковый комплекс.
Известно, что флуоресцентные белки состоят из ароматического флуорофора и полипептида. Флуорофором целентерамид-содержащих белков, как следует из их названия, является молекула целентерамида, образующая комплекс с полипептидом. Входящая в состав комплекса молекула целентерамида, фотохимически активна; при возбуждении светом она способна к отдаче протона, как показано на рис. 1.
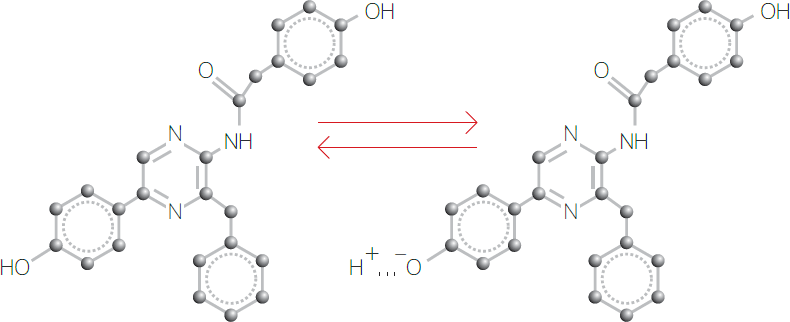
Рис. 1. Химическая структура молекулы целентерамида
Перенос протона меняет цвет флуоресценции целентерамида: форма целентарамида, содержащая протон, характеризующаяся "фиолетовой" флуоресценцией, депротонированная форма характеризуется "сине-зеленой" флуоресценцией.
Ученые Красноярска показали, что термические, химические и радиационные воздействия изменяют спектры флуоресценции целентерамид-содержащего белка. В качестве примера такого белка они использовали "разряженный обелин" — продукт биолюминесцентной реакции морского кишечнополостного обелии. На рис. 2 представлены спектры флуоресценции этого белка. Из рисунка видно, что воздействие химических агентов или радиации изменяет вклады цветных компонент — увеличивает вклад фиолетовой и уменьшает вклад сине-зеленой флуоресценции. Токсический эффект оценивается именно по изменению вкладов этих компонент.
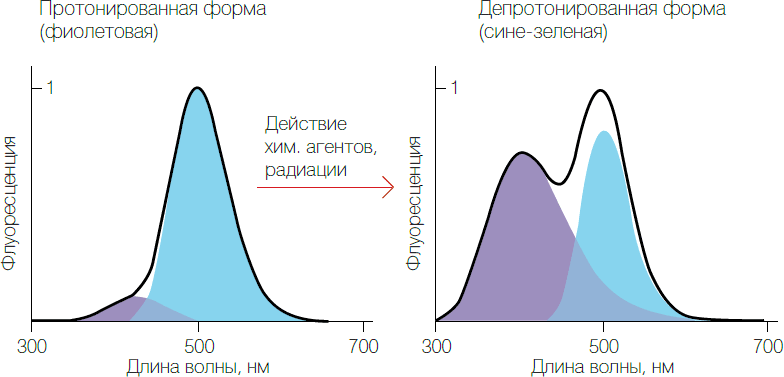

Рис. 2. Изменение спектров флуоресценции целентерамид-содержащих белков под действием химических реагентов и радиации
Рис. 2. Изменение спектров флуоресценции целентерамид-содержащих белков под действием химических реагентов и радиации
Возможность использования целентерамид-содержащих белков для оценки химической и радиационной токсичности обоснована в недавнем обзоре красноярских ученых (Talanta, 2017). Преимущества использования этих белков связаны с их фотобиологической активностью: так как перенос протона в возбужденном состоянии — чрезвычайно быстрый (наносекундный) процесс, скорость одного измерения лимитируется только длительностью регистрации спектра флуоресценции. Причем воспроизводимость этих измерений высока; она соответствует воспроизводимости физических экспериментов. Это важно для решения проблемы воспроизводимости биологических измерений, которая всегда возникает при использовании организмов и ферментативных реакций.
Последнее исследование красноярских ученых было связано с изучением воздействия на флуоресцентный белок низкодозовой радиации. Оно выполнено в сотрудничестве с коллегами из Московского государственного университета (кафедра радиохимии), результаты опубликованы в журнале Analytical&Biochemical Chemistry. В качестве радиоактивного элемента в этих экспериментах выбран тритий, бета-излучающий изотоп водорода, который принято считать одним из наименее токсичных радиоизотопов.
На рис. 3 показано изменение вкладов фиолетовой и сине-зеленой компонент спектра флуоресценции белка под действием трития. Тритий входил в состав тритиевой воды, которую добавляли в раствор белка. Наблюдения проводили в течение 18 суток. Максимальная доза радиоактивности, накопленная образцом белка, оказалась равной 0,28 Грей, что близко к условной границе малых доз. Из рисунка видно, что воздействие трития приводит к увеличению вклада фиолетовой и уменьшению вклада сине-зеленой компонент по сравнению с контрольными образцами. Видно также, что даже сутки воздействия трития (соответствующего дозе 0,03 Грей) вызывают заметные изменения вкладов цветных компонент, что указывает на высокую чувствительность белка к низкодозовому излучению.
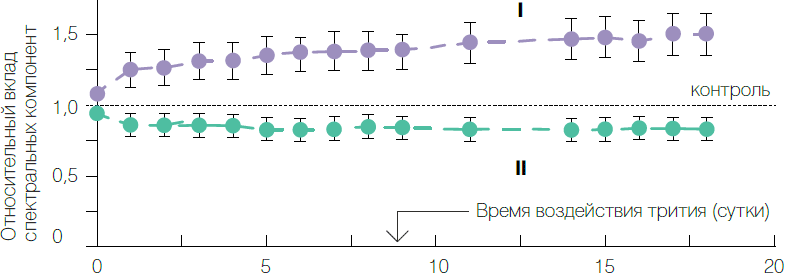

Рис. 3. Вклады фиолетовой (I) и сине-зеленой (II) компонент в спектры флуоресценции целентерамид-содержащего белка ("разряженного обелина") при различных временах воздействия трития (200 МБк/л)
Рис. 3. Вклады фиолетовой (I) и сине-зеленой (II) компонент в спектры флуоресценции целентерамид-содержащего белка ("разряженного обелина") при различных временах воздействия трития (200 МБк/л)
Таким образом, красноярскими учеными предложен принципиально новый подход к изучению токсичности с использованием простейшей биотестовой системы — флуоресцентного белка, его фотобиологических свойств и регистрации флуоресценции "цветных" компонент фотобиологического процесса. Предлагаемый подход переводит понимание токсических эффектов на уровень элементарных физико-химических процессов.
Тритий и его биологическая активность
Тритий в малых количествах всегда присутствует в окружающей среде, в основном в виде тритиевой воды, так как он постоянно образуется под действием космического излучения в верхних слоях атмосферы. До начала ядерной эры концентрация трития в природной воде была достаточно низкой — один атом трития на 1018 атомов нерадиоактивного изотопа водорода, протия. Однако после проведения испытаний термоядерного оружия в атмосфере (конец 50-х — начало 60-х годов ХХ века) концентрация трития повысилась почти в 1000 раз. И хотя после прекращения испытаний концентрация трития снижалась, в последние годы наблюдается локальное увеличение содержания трития в окружающей среде как результат работы атомных электростанций.
В процессе распада тритий (3H) превращается в положительно заряженный изотоп гелия-3 с испусканием электрона и антинейтрино. Максимальный пробег образующихся при распаде бета-частиц (электронов) в воздухе 5,8 мм при 20?С, в биологической ткани — 6,5 мкм. Бета-частицы трития полностью поглощаются роговыми слоями кожи, так что внешнее облучение организма тритием и его соединениями не представляет опасности. Опасно его попадание в организм через кожу, легкие или при приеме пищи и воды и распад уже в организме. Являясь изотопом водорода, тритий химически ведет себя так же, как и нерадиоактивный водород (протий), и поэтому способен замещать его во всех соединениях с кислородом, серой, азотом, легко проникая в протоплазму любой клетки. В этом случае распад трития способен серьезно повредить внутриклеточные структуры, включая генетический аппарат клеток.
Предложенный красноярскими учеными подход переводит понимание токсических эффектов на уровень элементарных физико-химических процессов
Важную роль в физико-химических процессах, сопровождающих распад трития, играет перераспределение электронной плотности в среде. При распаде трития возникает бета-частица и положительно заряженный ион гелия-3. Последняя частица чрезвычайно активна, она склонна к акцептированию электрона из окружающей среды (например, ближайшей органической молекулы) с образованием устойчивой оболочки инертного газа. При этом инициируются катион-радикалы различной активности. Таким образом, продукты бета-распада трития способны запускать (или активизировать) цепи переноса заряда/электрона в биохимических процессах. В результате описанных процессов локальное воздействие при распаде трития может быть достаточно эффективным. Поэтому изучение биологических эффектов трития является одной из актуальных задач современной биофизики и радиобиологии и имеет практическое значение для безопасного развития атомной индустрии.
Словарь
Флуорофор — фрагмент молекулы, придающий ей флуоресцентные свойства.
Пептид, полипептид, белок —
Аминокислоты способны соединяться связями, которые называются пептидными, при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид; если от 10 до 40-50 аминокислот — полипептид, если аминокислот больше — белок.
Грей — единица поглощенной дозы ионизирующего излучения в Международной системе единиц. Доза равна одному грею, если в результате поглощения ионизирующего излучения вещество получило один джоуль энергии на один килограмм массы.

