Успехи ДНК-редактирования в медицине зависят не столько от достижений молекулярной биологии в разработке инструментов редактирования, сколько от адекватности выбора конкретных пациентов с конкретными дефектами наследственности. Редактирование генома человека можно начать с гена наследственной глухоты.

Если оба
родителя – люди
с наследственной тугоухостью, обусловленной геном белка коннексина
26, у них рождается ребенок с такой же наследственной тугоухостью
Фото: Fairfax Media via Getty Images
Если оба
родителя – люди
с наследственной тугоухостью, обусловленной геном белка коннексина
26, у них рождается ребенок с такой же наследственной тугоухостью
Фото: Fairfax Media via Getty Images
Признанная в 2012 году прорывом года (по версии журнала Science) технология геномного редактирования CRISPR/Cas9 вывела методические приемы на принципиально иной уровень. Внесение направленных и очень точных изменений в генетический код стало воспроизводимой и рутинной процедурой. Уже в 2013 году технологию CRISPR/Cas использовали для изменения генома аквариумной рыбки-зебры Danio rerio, а в начале 2014 года опубликованы результаты экспериментов на обезьянах.
В 2015 году о планах по модификации геномов человеческих эмбрионов при помощи CRISPR/Cas заявили по меньшей мере четыре лаборатории в США, лаборатории в Китае и Великобритании, а также американская биотехнологическая компания Ovascience. В феврале 2016 года группе британских ученых было дано разрешение на генетическую модификацию человеческих эмбрионов с помощью CRISPR/Cas и родственных методов. И наконец, в конце ноября прошлого года на конференции «Редактирование генома человека» в Гонконге китайский исследователь Цзянькуй Хэ объявил о рождении двух девочек-близнецов после успешного редактирования генома и об одной развивающейся беременности после пересадки отредактированных эмбрионов. Научной публикации по общепринятым стандартам он пока не представил, судить о результате можно только по его докладу и предваряющему его интервью.
Направления практического применения технологий геномного редактирования в медицине:
• Вирусные заболевания (ВИЧ)
• Онкология
• Моногенные заболевания
• Тяжелые комбинированные иммунодефициты
• Направленные модификации генома человека
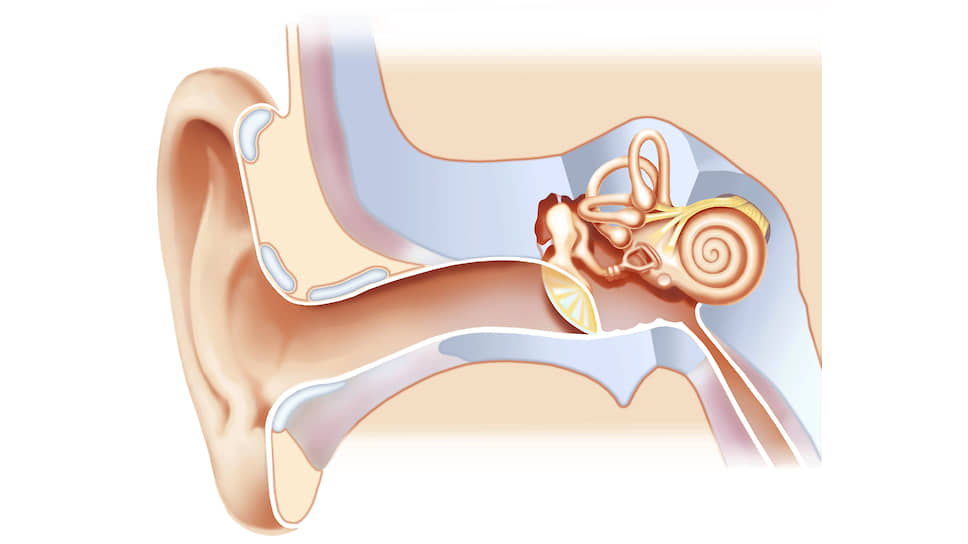
Почему глухие
Редактирование генома — это вариант генной инженерии, при котором фрагменты ДНК в геноме можно вставлять, удалять или заменять. По сути, это как текстовый редактор в компьютере, но редактируете вы не инструкцию по сборке шкафа, а инструкцию по «сборке» живого существа. Только нужно ли это делать?
С момента открытия двойной спирали ДНК исследователи и клиницисты размышляли о возможности исправления нарушений в нашей ДНК с целью устранения генетического заболевания. Дело в том, что у людей (как и других живых организмов) встречаются «плохие варианты генов», попадание которых в ребенка ведет к наследственному заболеванию. Заболевание развивается от неправильного текста в ДНК, не той буквы в последовательности гена. Каждый здоровый человек является носителем около пяти таких «плохих вариантов», но лишь в одной копии из двух, поэтому он не болеет. Однако сочетание мутации одного и того же гена от обоих родителей ведет к наследственному заболеванию, и по статистике с наследственным заболеванием рождается примерно каждый сотый ребенок. На сегодня известно более 7 тыс. наследственных заболеваний. Зачатие — это как лотерея, где в среднем вероятность проигрыша невелика (1%), но для конкретной пары родителей она может достигать 100%.
Современные технологии генетического скрининга позволяют предсказать вероятность рождения ребенка с наследственным заболеванием, и если она велика (25–100%), принять меры для отбора (или создания) здорового эмбриона в рамках процедуры экстракорпорального оплодотворения (ЭКО).
Важно отметить, что в подавляющем большинстве случаев никакого редактирования ДНК не требуется! Поскольку для конкретной пары родителей, несущих один и тот же мутантный ген в гетерозиготном состоянии, существует вероятность, что в результате случайного сочетания гамет образуется здоровый эмбрион (эта вероятность, как правило, составляет 25%, 50% или 75%), и достаточно просто выбрать этот здоровый эмбрион при процедуре ЭКО. Такой подход называют «предимплантационной генетической диагностикой».
И лишь в тех редких случаях, когда ни одно сочетание гамет не может дать здорового ребенка, можно обсуждать починку мутации на уровне первой клетки — зиготы. Такое редактирование генома называют «фетальным» (в отличие от «соматического», когда исправляют мутацию в некоторых клетках уже живущего человека).
И таких случаев «необходимого» вмешательства в геном на уровне эмбриона крайне мало! Это случаи, когда оба родителя болеют редким наследственным заболеванием и при этом образовали семейную пару. Практически невероятное сочетание факторов. Но в ряде случаев как раз заболевание работает на объединение таких людей в семьи. Например — глухота.
Люди с наследственной тугоухостью часто образуют семейные пары, поскольку могут общаться на одном языке и понимают особенности друг друга. К сожалению, 80% всех случаев наследственной тугоухости приходится на один и тот же ген (ген белка коннексина 26), и семейных пар с такой мутацией (в гомозиготном состоянии) немало. У таких родителей может родиться лишь ребенок с такой же наследственной тугоухостью. Генетическое тестирование в ЭКО тут не поможет, поскольку все эмбрионы будут с мутацией. Вот в этом случае можно попытаться исправить мутацию еще до переноса эмбриона будущей маме, на стадии самой первой клетки организма — зиготы.
В нашей лаборатории до высокой степени готовности отработаны методики редактирования генома на нескольких моделях: ВИЧ, глухота, карликовость и фенилкетонурия. ВИЧ и глухота — наиболее вероятные ситуации, где их можно будет применить. Более того, уже есть кандидаты на ДНК-редактирование — семьи с глухими детьми, у которых все дети обречены рождаться глухими.
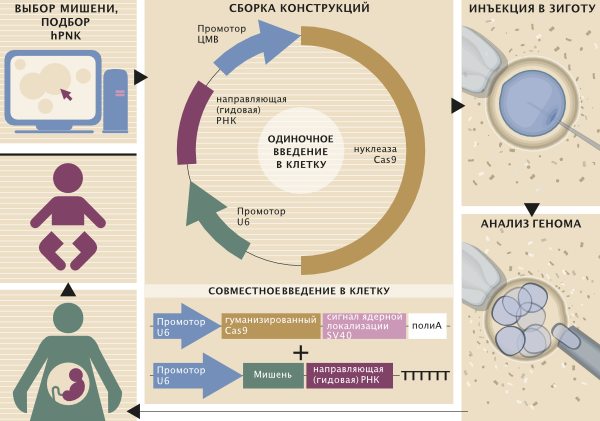

Возможный алгоритм фетальной терапии на основе CRISPR/Cas9
Возможный алгоритм фетальной терапии на основе CRISPR/Cas9
Персонифицированная ДНК-медицина
Очевидно, что для переноса технологии из лаборатории в клиническую практику необходимо выполнить одно очень жесткое требование: доказать безопасность применяемой системы редактирования генома. Дело в том, что исправление конкретной мутации в ДНК не должно приводить к появлению каких-либо иных изменений в других частях генома. Если «генетический редактор» будет работать неточно, последствия могут быть очень печальными.
Кроме этого, первые случаи применения геномного редактирования на уровне зиготы должны быть абсолютно понятны и научному сообществу, и общественности. Областей, где геномное редактирование может быть единственным возможным методом излечения потомства, немного. Во-первых, это ряд аутосомно-рецессивных наследственных заболеваний, как, например, наследственная тугоухость, карликовость, в меньшей степени — фенилкетонурия (из-за наличия эффективного лечения) и небольшой ряд других моногенных патологий. Другой возможный пример — ВИЧ-положительные женщины с плохим ответом на антиретровирусную терапию, планирующие беременность. Для них риск передачи вируса ребенку гораздо выше, чем для нормально реагирующих на лечение ВИЧ+ женщин.
Только после многократного применения в разных точках планеты разными врачами и получения однозначно хороших результатов можно начать думать о применении данной технологии для исправления более частых мутаций, приводящих к развитию мультифакторных заболеваний у людей во взрослом состоянии. Мы могли бы «заранее» чинить предрасположенность эмбриона к развитию онкологического заболевания, раннему инсульту, инфаркту, нейродегенеративным заболеваниям и пр.
К сожалению, система допуска подобных (принципиально новых) препаратов к медицинскому применению на сегодня не проработана и требует уточнения алгоритмов проверки и эффективности, и безопасности. Но в целом можно утверждать, что в любом случае эти препараты будут подпадать под персонифицированные (одобренные к применению для конкретного человека или семейной пары), поскольку геномы людей отличаются и предсказать фоновую активность препарата на данном конкретном геноме без экспериментальной проверки невозможно. Алгоритм применения будет включать полное определение генома будущих родителей и проверку на их собственных клетках и гаметах.
Если же вернуться к исправлению мутаций у уже родившегося человека, то здесь с разрешениями больших проблем не предвидится. Ряд биотехнологических компаний уже ведут клинические испытания препаратов для генной модификации человека на основе CRISPR/Cas как терапии при некоторых врожденных заболеваниях.