Сотрудники химического факультета МГУ совместно с коллегами из Орхусского университета (Дания) определили скорость инициируемой светом реакции для молекулы, отвечающей за возникновение зрительного сигнала,— одного из самых быстрых биохимических превращений в природе. Исследование ученых опубликовано в журнале Nature Communications.
Фото: Анатолий Жданов, Коммерсантъ / купить фото
Процессы, происходящие в природе под действием света, такие как фотосинтез у растений, зрение у позвоночных, сопровождаются химическими превращениями хромофорных групп фотоактивных белков — небольших молекул, отвечающих за поглощение кванта световой энергии. Ученые десятилетиями изучают факторы, влияющие на высокую эффективность светозависимых биохимических процессов в живых организмах. Фотохимические превращения в живых системах происходят с невероятными скоростями — на временах порядка сотен фемтосекунд (10–13 с). Хромофорной группой всех без исключения зрительных пигментов человека и животных является альдегид витамина А, или ретиналь, причем только одна из его многих изомерных форм. Сопряженная система двойных связей ретиналя отвечает за поглощение света в видимом диапазоне.
Родопсин — зрительный пигмент, находящийся в палочках сетчатки глаза человека и животных. Эта сложная молекула представляет собой хромопротеин, содержащий одну хромофорную группу и водонерастворимый мембранный белок опсин. Опсин — сравнительно небольшой белок, его полипептидная цепь состоит из 348 аминокислотных остатков, расположенных в семи -спиралях. Ретиналь соединен с аминокислотным остатком лизином, находящимся в седьмой -спирали. Гидрофобные взаимодействия -иононового кольца с гидрофобной частью опсина также позволяют более жестко фиксировать ретиналь в хромофорном кармане.
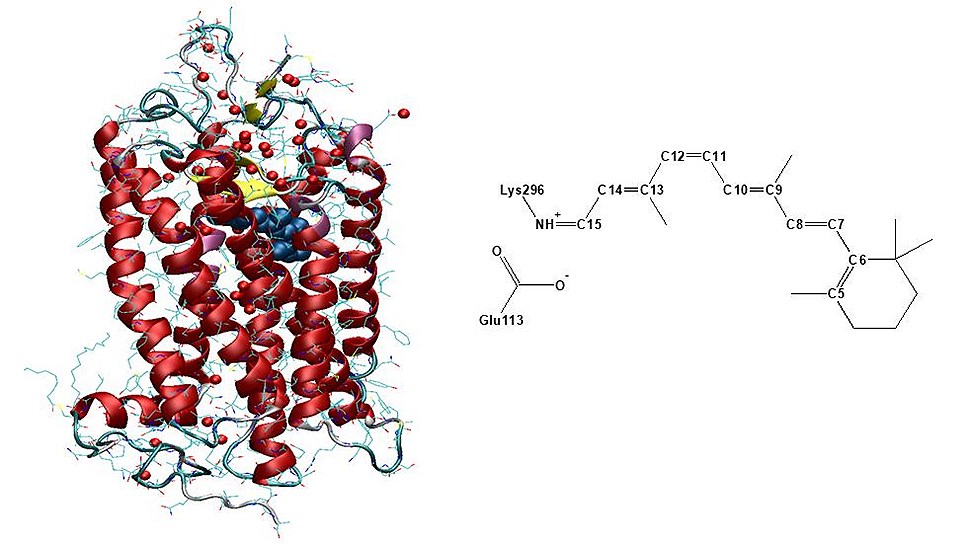
Белок родопсин и его хромофорная группа — ретиналь
Преобразование световой энергии в химический отклик происходит за счет протонной проводимости в родопсине. Ретиналь перекрывает центральный канал родопсина и, поглощая квант света, изомеризуется — у двойных связей в молекуле ретиналя заместители меняют свои положения, а затем депротонируется (сбрасывает протон). Эти процессы сопровождаются изменением взаимодействия ретиналя с белком и конформации белка. Депротонирование хромофорной группы приводит к переносу протона, а также возникновению трансмембранной разности потенциалов на фоторецепторной мембране за счет сдвига протона в мембране.
Механизм изомеризации ретиналя у бактерий и животных различается: при поглощении фотона цис-форма переходит в транс-изомер у животных, а у бактерий наоборот — транс-изомер ретиналя переходит в цис-форму. Цис- и транс-формы отличаются положением заместителей у кратной связи: у цис-изомеров длинные углеводородные заместители находятся «по одну сторону» от двойной связи, а у транс-изомеров — по разные стороны. Времена этих превращений определили за последние десять лет как для одиночных молекул ретиналя в растворе, так и в составе светочувствительных белков — зрительных фоторецепторов с помощью фемтосекундной спектроскопии.
Фемтосекундная спектроскопия с временным разрешением основана на лазерах, генерирующих импульсы света фемтосекундной (10–15 с) длительности. В фемто- и пикосекундной спектроскопии лазерный импульс создает в исследуемом образце неравновесное состояние, переводя молекулу из основного состояния на энергетически более высокие возбужденные уровни. Затем в различные моменты времени происходит измерение спектральных характеристик, несущих информацию о ходе релаксации вещества в основное состояние или о происходящих в нем фотопревращениях.
Фемтосекундная техника получила ускоренное развитие в начале XXI века, после награждения Нобелевской премией по химии американо-египетского ученого Ахмеда Зевейла за исследование переходных состояний в химических реакциях фемтосекундным способом в 1999 году. Изучение скорости изомеризации ретиналя в белке с помощью фемтосекундной спектроскопии исследовательские группы проводят начиная с 2010 года. В ходе экспериментов молекулы ретиналя подвергают двойному облучению короткими световыми импульсами. Первый фотон «выводит из равновесия» молекулу на более высокий энергетический уровень. Второй импульс, который называют зондирующим, направляют с временной задержкой, и, если он по энергии совпадает с разницей между основным и возбужденным уровнями молекулы, ретиналь вынужденно испускает излучение и переходит обратно на основной уровень. Энергия зондирующего импульса может соответствовать разнице между первым возбужденным и другим, более высоким энергетическим уровнем молекулы. Тогда ретиналь поглощает фотон зондирующего излучения. Варьируя в широком диапазоне время задержки между двумя импульсами и энергию зондирующего импульса, ученые-экспериментаторы получают сложный «лес» из спектров поглощения и испускания молекулы в зависимости от энергии и времени. Интерпретируют и обрабатывают массив данных специалисты, владеющие расчетными методами квантовой химии и динамики.
Скорость фотоизомеризации ретиналя в водном растворе падает в сотни раз по сравнению со скоростью реакции в белковом окружении. В связи с этим возник фундаментальный вопрос, оказывает ли белковое окружение ускоряющее (каталитическое) воздействие на реакцию или оно просто защищает молекулу ретиналя от воздействия растворителя. Чтобы ответить на этот вопрос, необходимо было провести фемтосекундный эксперимент с ретиналем, на который не оказывает никакого влияния окружение, в условиях высокого вакуума.
Российские и датские ученые впервые ответили на этот вопрос. Научные коллективы двух стран сотрудничают почти десять лет. За это время сформировалось разделение труда: датчане занимаются фемтосекундными экспериментами, а россияне — теорией и расчетами полученных спектров.
Датские химики под руководством профессора Ларса Андерсена (Prof. Lars H. Andersen) разработали новый экспериментальный метод для исследования заряженных биологических хромофоров в газовой фазе с использованием фемтосекундной спектроскопии с временным разрешением и современных ион-накопительных технологий. Главная трудность в постановке эксперимента была связана с выбором подходящего сигнала от разреженных в вакууме молекул, поглотивших один (импульс накачки) или два (импульс накачки и импульс зондирования) фотона. В растворе изучать спектры поглощения и испускания гораздо проще: высокая концентрация молекул позволяет увидеть различия в интенсивности падающего и проходящего через раствор излучения. В газовой фазе концентрация молекул в единице объема намного порядков ниже, чем в растворе: увидеть в падающем и проходящем излучении различия современная спектральная техника не позволяет. Датским экспериментаторам пришлось по косвенным признакам рассчитывать количество поглощенных ретиналем квантов излучения. Положительно заряженные молекулы ретиналя в спектрометре разгонялись по кольцу, а количество поглощенных фотонов специалисты связывали с числом распавшихся на более мелкие фрагменты молекул ретиналя и временем, через которое возбужденная молекула диссоциировала. Специалисты Орхусского университета приобрели фемтосекундный лазер в 2013 году и в течение нескольких лет занимались подготовкой эксперимента и решением проблемы детектирования спектров поглощения.
Сотрудники лаборатории квантовой фотодинамики, созданной в прошлом году на химическом факультете МГУ по программе развития Московского университета, провели анализ результатов и интерпретировали полученные данные с помощью квантово-химических расчетов высокого уровня точности. Моделирование механизмов фотохимических реакций требует огромной вычислительной мощности. Расчеты российские химики проводили на суперкомпьютерном комплексе «Ломоносов» Московского университета. Для расчета одного профиля пути реакции фотоизомеризации на поверхности потенциальной энергии электронно-возбужденного состояния — характеристики, связывающей время реакции, энергию системы и состояние молекулы, необходимо проводить вычисления на более чем 1000 ядрах суперкомпьютера от недели до месяца. Для публикации специалистам необходимо было построить как минимум шесть профилей пути реакции.
В процессе обработки спектральных данных российским химикам пришлось столкнуться с не меньшим числом проблем, чем экспериментаторам. «В эксперименте ретиналь, находящийся в газовой фазе, может подвергаться изомеризации просто под действием солнечного света, а также реакция может быть активирована термически на поверхности основного электронного состояния. В связи с этим не очень понятно, с какой по составу изомеров системой работаешь изначально. Мы только через некоторое время поняли, что в эксперименте мы имеем дело со смесью изомеров и разные характеристические времена в динамике релаксации электронно-возбужденного состояния, наблюдаемые экспериментально, относятся к разным изомерам»,— рассказала один из соавторов, доцент, руководитель лаборатории квантовой фотодинамики, к. ф.-м. н. Анастасия Боченкова.
Российские специалисты установили, что фотоизомеризация ретиналя в газовой фазе действительно может быть очень быстрой — сотни фемтосекунд для цис-изомера, и медленной — несколько пикосекунд (10-12 с) для полностью транс-изомера. Таким образом, ученые выяснили, что первичная фотохимическая реакция в белках зрительной рецепции проходит так же быстро, как и для изолированной молекулы ретиналя. Бактериальные родопсины, напротив, значительно ускоряют реакцию и, более того, меняют специфичность реакции изомеризации по сравнению с изолированной хромофорной группой.
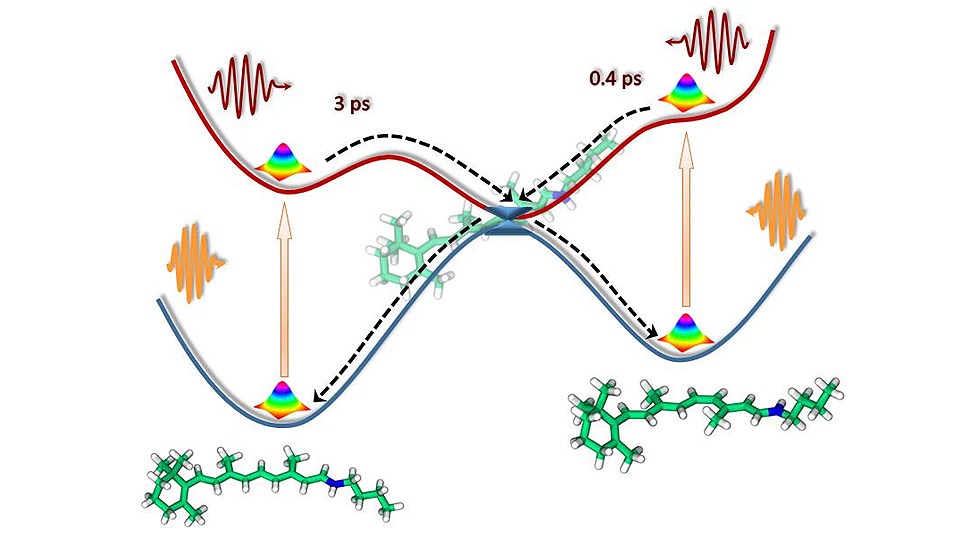
Профиль реакции фотоизомеризации ретиналя. Слева — транс-изомер, справа — 11-цис-изомер
«Наши результаты показывают возможность принципиально нового подхода в исследованиях фотохимических реакций в белках. Изучение эталонных реакций, таких как превращения изолированных хромофорных групп фотоактивных белков, помогает сделать заключение о том, как функционируют белки и какова роль белкового окружения»,— объяснила Анастасия Боченкова.
Исследование выполнено при поддержке гранта Российского научного фонда.

