Трансгенные люди. Первый блин комом
События / генная инженерия
На конференции «Редактирование генома человека», которая проходила 27–29 ноября в Гонконге, китайский исследователь Цзянькуй Хэ объявил о рождении двух девочек-близнецов после успешного редактирования генома и об одной развивающейся беременности после пересадки отредактированных эмбрионов. Его сообщение вызвало бурное обсуждение во всем мире, в основном с морально-этических позиций. Но что же было им сделано по существу?

Фото: ALEX HOFFORD / EPA / ТАСС
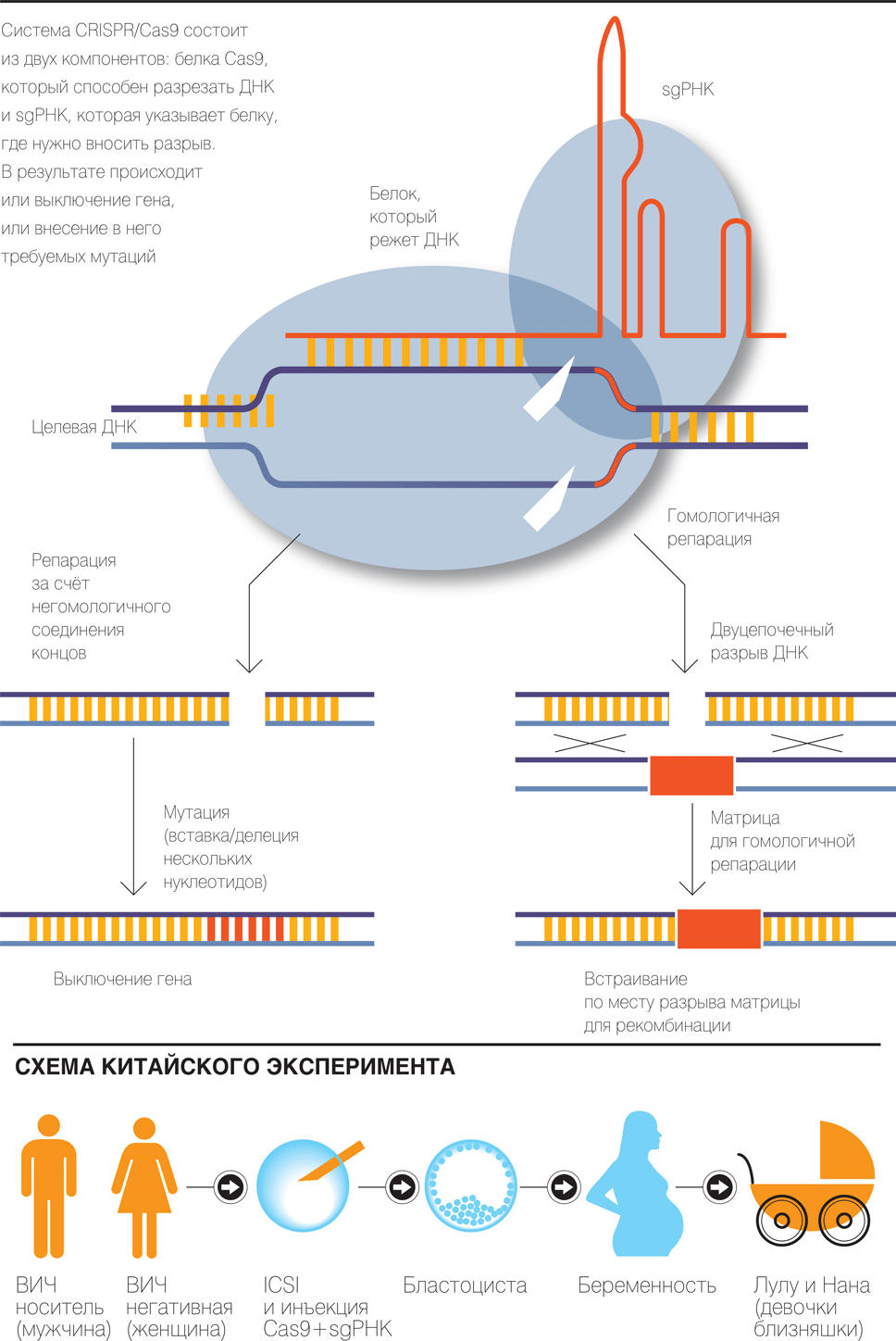
Если коротко, то суть современной технологии геномного редактирования состоит во внесении двуцепочечных разрывов в ДНК с помощью «молекулярных ножниц» — белка CRISPR/Cas9, после чего клетка, залечивая этот разрыв, или вносит случайные мутации, или, используя внесенную исследователем матрицу для репарации, вносит «подсказанные» изменения в геном (подробно метод описан в сентябрьском номере “Ъ-Науки” в статье «Конструирование коровы» ).
Этот метод из-за своей простоты и эффективности находит все большее применение в научных исследованиях, а в Институте биологии гена РАН при поддержке департамента образования города Москвы даже проводятся курсы для школьников и учителей, где они сами разрабатывают систему генного редактирования на основе CRISPR/Cas9. Пользуясь онлайн-сервисами на сайтах ведущих исследовательских центов мира, выбирают ген для нокаута, подбирают оптимальную sgРНК, анализируют наличие сайтов (мест в ДНК) для неспецифичного разрезания.
Этот же метод был использован для редактирования генома и в работе Цзянькуй Хэ.
Научной публикации по общепринятым стандартам он не представил, и обсуждаются здесь только доклад и слайды, представленные на конференции, а также серия его интервью, их предваряющая. Своей целью Цзянькуй Хэ поставил спасение человечества от вируса иммунодефицита человека. Дети, геном которых редактировался, имели повышенный риск инфицирования этим вирусом, поскольку их отец был носителем ВИЧ.

В качестве цели для геномного редактирования был выбран ген CCR5, который копирует многофункциональный белок C-C-рецептор хемокина 5. Кроме связывания с ВИЧ этот белок участвует более чем в 20 биологических процессах (передача сигнала внутри клетки и между клетками, направленное перемещение клеток, управление воспалительным процессом и т. д.). В 2018 году появились данные, что его отсутствие приводит к развитию рассеянного склероза из-за нарушения контроля над воспалительными процессами в мозге.
У европейцев обнаружена природная мутация CCR5-delta32, которая в гомозиготе обеспечивает устойчивость к ВИЧ. Считается, что возникла она в европеоидном этносе 700 лет назад и быстро распространялась по Европе на фоне древней эпидемии, возможно, чумы. Когда давление отбора ослабло (эпидемии отбушевали), мутация начала вымываться из генома.
С этого момента начинаются биологические вопросы к плану эксперимента (опуская юридические, этические, эпидемиологические).
В данном случае был внесен двуцепочечный разрыв в ДНК раннего эмбриона (на стадии 1–4 бластомеров), что запустило механизм случайного соединения концов ДНК (матрица для направленного восстановления целостности ДНК использована не была).
В результате, как и должно было быть, по месту разрезания произошли непредсказуемые, случайные изменения последовательности ДНК — у одного ребенка делеция одного и вставка четырех нуклеотидов в обеих гомологичных хромосомах, у другого только делеция 15 нуклеотидов в одной хромосоме.
В первом случае после точки мутации будет нарушена аминокислотная последовательность белка, цепочка аминокислот быстро оборвется, как такой укороченный пептид будет себя проявлять в клетке, предсказать невозможно.
Поскольку нарушены обе копии гена, ВИЧ инфицировать эту девочку не будет, но ее дети эту защиту утратят (если их отцом не будет гомозиготный носитель природной или искусственной мутации в этом гене).
Вторая девочка и ее дети чувствительность к вирусу сохранят. Отсутствие 15 нуклеотидов (5 из 352 аминокислот) не приведет к драматичному нарушению в структуре белка, но и не защитит от ВИЧ.
При этом, как, например, в случае массового удаления аппендицитов без всяких на то оснований, в борьбе с одним заболеванием мы провоцируем множество других, о которых и не думали до этого.

С точки зрения генетики научного значения эта работа не имеет, мутация, которую рассчитывал получить Цзянькуй Хэ, в геноме человека известна, и, если поставить задачу, можно за два-три поколения получить внуков-правнуков, гомозиготных по аллелю устойчивости к ВИЧ. При этом, возможно, историческая мутация была не одна, и ее эффект на нарушение тех самых 20 функций белка компенсировался другими мутациями, усилившими другие белки, о которых мы не знаем.
Грубо нарушив систему иммунной защиты человека, мы скорее нанесем вред, чем пользу. При этом использованный вариант CRISPR/Cas9 заведомо генерировал случайные замены в известном месте и, возможно нарушил последовательность ДНК и в других местах генома. На текущем уровне развития науки рано говорить о том, что мы готовы управлять геномом человека, пока генная терапия направлена на восстановление правильной функции гена, а не на нарушение нормально работающего, но кажущегося «лишним».
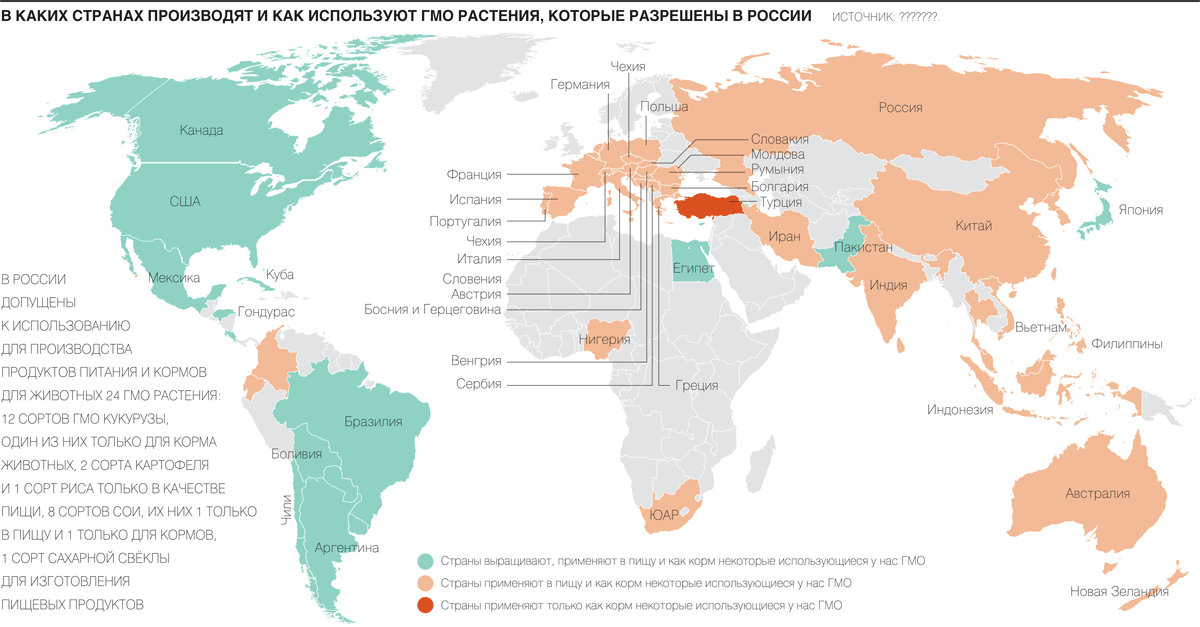
Где производят и как используют ГМО-растения, которые разрешены в России
В России допущены к использованию для производства продуктов питания и кормов для животных 24 ГМО-растения: 12 сортов ГМО-кукурузы, один из них только для корма животных, 2 сорта картофеля и 1 сорт риса только в качестве пищи, 8 сортов сои, их них 1 только в пищу и 1 только для кормов, 1 сорт сахарной свеклы для изготовления пищевых продуктов.
- Зеленый — выращивают, применяют в пищу и как корм некоторые использующиеся у нас ГМО
- Желтый — применяют в пищу и как корм некоторые использующиеся у нас ГМО
- Красный — применяют только как корм некоторые использующиеся у нас ГМО
Трансгенные животные, которых уже использует человек
для производства лекарственных белков человека
- трансгенные кролики (С1 ингибитор)
- трансгенные козы (антитромбин)
и в пищу
- трансгенный лосось.
Какие препараты для генной терапии используют сейчас
Gendicine (гендицин), аденовирус доставляет белок p53 — противораковый препарат, Китай
Neovasculgen (неоваскулген), плазмида, кодирующая эндотелиальный фактор роста сосудов — препарат против ишемии конечностей, Россия
Glybera (глибера), аденоассоциированный вирус серотип I доставляет липопротеинлипазу — профилактика ферментативной недостаточности, Евросоюз
Eteplirsen (этеплирсен), зкзонскипинг 51 экзона гена дистрофина — лечение дистрофии Дюшенна, США

